quarta-feira, 22 de maio de 2013
Colorações

segunda-feira, 25 de julho de 2011
Bactéria “gigante”: algumas espécies são visíveis a olho nu

Se você achava que bactéria era sinônimo de “ameaça invisível”, lamento informar que você não está de todo certo.
De fato, a maioria das bactérias é minúscula, muito pequena para ser vista a olho nu. Há boas razões para isso: enquanto as células complexas das plantas e animais têm sistemas de transporte internos para mover moléculas ao redor, as bactérias se baseiam principalmente na difusão para mover coisas ao redor de suas células. Uma vez que a difusão só funciona bem em distâncias de até alguns milionésimos de metro, as bactérias não podem crescer muito.
No entanto, algumas espécies conseguiram realizar a façanha. Na verdade, pelo menos três são tão grandes que podem ser vistas sem ajuda de um microscópio.
A primeira gigante foi descoberta em 1985, mas devido ao seu tamanho, não foi reconhecida como uma bactéria até oito anos mais tarde. A Epulopiscium fishelsoni (na foto) tem a forma de bastonete, vive no intestino de peixes-cirurgiões no Mar Vermelho, e chega até 0,7 milímetros de comprimento (o que é centenas de vezes maior do que, por exemplo, a bactéria E. coli que mora no nosso intestino e tem cerca de 0,002 milímetros de comprimento).
A E. fishelsoni alcança esse tamanho “máximo” por ter dezenas a centenas de milhares de cópias de seu DNA.
Isso significa que ela pode produzir proteínas em muitos lugares diferentes em sua célula, de forma que elas só precisam se difundir a uma curta distância para chegar até onde são necessárias. Cálculos recentes mostram a proporção de DNA por volume na E. fishelsoni é o mesmo para uma bactéria de tamanho normal.
A E. fishelsoni manteve o título de maior bactéria até 1997, quando Thiomargarita namibiensis apareceu para concorrer na categoria.
A T. namibiensis, que significa “pérola de enxofre da Namíbia”, por causa dos grânulos de enxofre brilhantes que moram dentro dela, chega a até 0,75 milímetros de diâmetro.
A bactéria conta com o mesmo truque de E. fishelsoni: milhares de cópias de seu DNA. Embora tenha um volume até 100 vezes maior do que a E. fishelsoni, a maior parte deste espaço é usado para armazenamento: 98% da célula é ocupada por uma membrana enorme, ou vacúolo.
Este vacúolo contém até três meses de fornecimento de nitrato, que a bactéria usa para oxidar o sulfeto de hidrogênio do qual se alimenta. O armazenamento é necessário porque o fornecimento de nitrato no fundo do mar é irregular, dependendo de animais mortos que afundam.
Uma bactéria quase idêntica a T. namibiensis, com 0,5 milímetros de diâmetro, também visível a olho nu, foi descoberta no México em 2002. Isso prova que provavelmente há mais bactérias gigantescas por aí, esperando para serem encontradas
BIBLIOGRAFIA:
www.hypescience.com
Acadêmica: Karen Quevedo
quinta-feira, 19 de maio de 2011
LISTERIA

As listérias se assemelham ao gênero Brochothrix. Ambos os gêneros são catalase-positivos e tendem a estar associados ao outro na natureza, assim como o Lactobacillus. Todos os três gêneros produzem ácido láctico a partir da glicose e de outros açúcares fermentados, mas os lactobacilos são catalase-negativos. Em certo momento as listérias foram colocadas na família Corinebacteriaceae, mas atualmente estão relacionadas à Bacillus, Lactobacillus e Streptococcus. A partir da seqüência de RNA ribossomal 16S, a Listeria está classificada próximo a Brochothrix, e estes dois gêneros, juntamente com Staphylococcus e Kurthia, ocupam uma posição entre o grupo dos Bacillus e dos Lactobacillus/Streptococcus dentro da ramificação Clostridium-Lactobacillus-Bacillus, onde a porcentagem de G+C de todos esses membros é inferior a 50%. Transferências genéticas ocorrem entre Listeria, Bacillus e Streptococcus, e reações imunológicas correm entre Listeria, Stphylococcus e Lactobacillus.
Listeria spp. contêm ácidos teicóico e lipoteicóico, assim como bacilos, estafilococos, estreptococos e lactobacilos, mas diferentemente destes grupos, suas colônias brilham quando visualizadas por luz transmitida obliquamente.
As listérias estão amplamente distribuídas na natureza e podem ser encontradas em vegetação deteriorada, solos, fezes de animais, silagem, esgotos e água. Em geral, podem ocorrer em locais onde bactérias corineformes estão presentes. Sua associação com certos produtos lácteos e silagem é bem conhecida, assim como a associação desses produtos de ácidos lácticos.
Oito espécies estão relacionadas ao gênero Listeria - L. monocytogenes, L. ivanovii, L. innocua, L. welshimeri, L. seeligeri, L. denitrificans, L.murrayi e L.grayi-, o mesmo tem sofrido constantes alterações taxonômicas. A espécie L. denitrificans foi reclassificada como Jonesia denitrificans e, recentemente as espécies L. grayi e L. murrayi foram agrupadas em uma única espécie, Listeria grayi. A espécie ivanovii, por sua vez, foi subdividida em duas subespécies: L. ivanovii subsp. ivanovii e L. ivanovii subsp. landoniensis. Mas a principal espécie patogênica e de importância para a microbiologia de alimentos é a Listeria monocytogenes.
A Listeria monocytogenes foi descrita pela primeira vez em 1911, desde então ela tem sido apresentada como um patógeno de mais de 50 mamíferos, incluindo humanos, e de aves silvestres, peixes e crustáceos. O primeiro caso de listerose humana, patologia provocada pela presença de Listeria, foi relatado em 1929, mas foi na década de 80 que se tornou um dos mais importantes patógenos veiculados por alimentos, isso devido à eclosão de diversos surtos de listerose humana.
A Listeria monocytogenes é um bacilo Gram-positivo, não formador de esporo, anaeróbio facultativo. E leva o nome de monocytogenes por apresentar atividade produtora de monócitos. Onde as células jovens, quando observadas no microscópio, apresentam-se na forma lisa, assemelhando-se a pequenos difteróides, medindo de 1,0 a 2,0μ por 0,5μ. Após três a cinco dias de incubação, no entanto, apresentam-se como bacilos longos, medindo de 6 a 20μ. O número de células presentes nos alimentos para que ocorra seu crescimento irá depender do tipo de alimento, e as taxas de prevalência podem variar de 105 a 108. Ela é móvel devido a flagelos peritríquios, apresentando movimentação característica chamada de tombamento, que auxilia na sua identificação. Apresenta catalase positiva e oxidase negativa.
Em estudos epidemiológicos, são importantes os esquemas de sorotipagem e fagotipagem. O esquema atual de sorotipagem de Listeria baseia-se na identificação de 15 antígenos somáticos (O) e cinco flagelares (H), sendo 16 sorovariedades reconhecidas para as cinco espécies do grupo um: L. monocytogenes, L. innocua, L. seeligeri, L. ivanovii subsp. ivanovii e L. ivanovii subsp. Landoniensis e L. welshimeri. O grupo dois é composto pela espécies Listeria grayi contém antígenos O e H específicos. Atualmente, existem 27 fagos para tipificação de L. monocytogenes.
Além da sorotipificação, muitos outros métodos têm sido aplicados para a caracterização de espécies e subespécies de L. monocytogenes. Entre os vários métodos, estão a tipificação por bacteriófagos, a tipificação por eletroforese com enzimas multilocus, análise por enzima de restrição, a eletroforese em gel de campo pulsado, fragmentos de restrição de tamanhos polimórficos de DNA e a tipificação ribossomal.
1.1 Crescimento
As necessidades nutricionais das listérias são típicas das bactérias Gram-positivas. Elas crescem bem em meios comuns como BHI, caldo triptona e caldo tripticase-soja. Embora muitas das necessidades nutricionais tenham sido descritas para L. monocytogenes, acredita-se que as demais espécies tenham necessidades similares. Pelo menos quatro vitaminas do complexo B são necessárias- biotina, riboflavina, tiamina e ácido tioctico-, bem como os aminoácidos cisteínas, glutamina, isoleucina e valina. A glicose aumenta o crescimento de todas as espécies, e vários outros carboidratos simples ou complexos são usados. A Listeria ssp. assemelha-se aos enterococos por ser capaz de hidrolisar esculina e crescer na presença de 10 a 40% de bile, 10% de NaCl, 0,025% de acetato de tálio e 0,04% de telurito de potássio, mas, diferentemente dos enterococos, ela não cresce na presença de 0,02% de azida de sódio. Ao contrário da maioria das bactérias Gram-positivas, as listérias crescem em ágar MacConkey. Embora o ferro seja importante para o crescimento in vivo, a L. monocytogenes aparentemente não possui composto ferro-específico, obtendo o que necessita por meio da mobilização de ferro livre reduzido, o qual se liga a receptores de superfície.
1.1.1. Efeito do pH
O pH ótimo para crescimento para o crescimento desta bactéria está entre 6 e 8, ela pode crescer em uma faixa maior, entre 5 e 9. Em meios de cultura, já se verificou seu crescimento em pH 9,5. Ambientes com pH inferior a 4,5 e superior a 9,5 são considerados hostis a L. monocytogenes. Mas existem relatos de crescimento em meio de cultura com pH de 4,4.
Em geral, o pH mínimo de crescimento de uma bactéria varia em função da temperatura de incubação, composição dos nutrientes, atividade da água e presença e quantidade de NaCl e outros sais inibidores.
1.1.2. Efeito de temperatura
L. monocytogenes apresenta crescimento na faixa de 2,5°C a 44°C, embora existam relatos sobre o crescimento a 0°C. Este microrganismo suporta repetidos congelamento e descongelamentos. O tempo de geração a 35ºC varia conforme o meio em que se encontra. Em meio de cultura de ágar tripticase-soja o crescimento de 78 linhagens de L. monocytogenes ocorre dentro de uma faixa de 0,5ºC a3,0ºC.
1.1.3 NaCl
Com relação à concentração de NaCl, contatou-se a sua sobrevivência em 10,5% incubada a 37ºC por 15 dias e 10 dias, respectivamente. Em concentrações de 20%-30% de NaCl, o tempo de sobrevivência foi reduzido para cinco dias. Mas, se a temperatura é reduzida para 4ºC, a bactéria pode sobreviver por mais de 100 dias em concentrações entre 10,5% e 30,5% de NaCl. Existe uma interação do Ph com o NaCl e a temperatura.
Em estudos foram observados crescimentos em pH de 4,66 o tempo para crescimento visível foi de cinco dias a 30ºC,sem adição de NaCl; oito dias, a 30ºC, com 4% de NaCl; e 13 dias, a 30ºC, com 6% de NaCl. Crescimento a 5º ocorreu somente após nove dias em pH 7,0 sem adição de NaCl; com adição de 4% de NaCl, em 15 dias foi observado crescimento; e com 6% de NaCl, foram necessários 28 dias. Os efeitos do pH e do NaCl foram determinados por serem puramente aditivos e, em nenhum momento, sinergéticos.
1.1.4. Efeito de Atividade da água
A atividade de água ótima para que ocorra crescimento é próxima a 0,97. Mas esta bactéria consegue se multiplicar em atividade de água considerada baixa para a multiplicação de patógenos, 0,92. Existem relatos de sobrevivência de L. monocytogenes a 4ºC por pelo menos 132 dias em caldo de tripticase de soja contendo NaCl na concentração de 25,5%, com atividade de água de 0,83 aproximadamente.
1.2. Características da doença.
É no intestino humano o ponto de entrada da L. monocytogenes no organismo, através das células epiteliais do ápice das microvilosidades. Onde se difundem, não só pelo interior desta célula como também de uma célula para outra. Na fase seguinte, são ingeridas por macrófagos, mas isso não significa uma resposta inflamatória significante. Uma vez as células de L. monocytogenes dentro dos macrófagos ficam protegidas dos leucócitos polimorfonucleares.
Estudos demonstraram que cepas virulentas são capazes de multiplicar-se em macrófagos, que são rompidos e produzem septicemia. Com isso o microrganismo pode atingir outras áreas do organismo, podendo envolver o sistema nervoso central, coração e outros locais. Em mulheres grávidas pode haver invasão do feto, aborto dependendo do estagio de gravidez, parto prematuro, nascimento de natimorto ou haver septicemia neonatal. Em recém-nascido quando infectado no momento do parto e os sintomas típicos de listerose são de uma meningite. A sintomatologia tem início de uma a quatro semanas após o nascimento, mas existem relatos de período de quatro dias.
Na fase entérica, a sintomatologia é semelhante de uma gripe, acompanhada de diarréia e febre moderada. Mas alguns casos estes sintomas são inaparentes. Pode ocorrer também estado de duração indefinida.
A ocorrência de bacteremia por L. monocytogenes em adultos não é rara. Febre é o sintoma mais comum, mas alguns pacientes queixam-se de fadiga, mal-estar, podendo haver presença de náusea, vômitos dores e diarréia. A mortalidade entre imunodeprimidos, debilitados e recém-nascidos é de 30%.
O comprometimento do SNC a manifestção dá-se através do aparecimento de meningite, encefalite e de abcessos. A meningite é a manifestação mais comum, ocorre principalmente em recém-nascidos e idosos. Seu desenvolvimento clínico é fulminante, com índice de mortalidade de, aproximadamente, 70%. Outras formas localizadas de listerose são a endocardite e osteomielite, mas são formas rara. O perído de incubação da listerose varia de um dia a algumas semanas, sendo dose infecciosa de L. monocytogenes desconhecida.
1.3. Mecanismo de Patogenecidade
A L. monocytogenes entra no organismo do hospedeiro por via oral, atinge o trato intestinal aderindo e invadindo a mucosa. Em seguida, a célula bacteriana é fagocitada por macrófagos. Após a lise da membrana fagocítica, é liberada no citoplasma da célula do hospedeiro, onde se multiplica rapidamente. Ocorre também a polimerização de filamentos de actina da célula do hospedeiro, formando longas caudas em uma das extremidades da célula bacteriana. Esses filamentos causam o deslocamento da bactéria no citoplasma, permitindo a invasão das células adjacentes, dando início a um novo ciclo de infecção.
Os fatores de virulência tentam explicar o mecanismo de patogenicidade de L. monocytogenes. Temos:
-Listeriolisina O (LLO)- é uma hemolisina produzida pela L. monocytogenes, faz parte da família da citolisinas formadas pela ativação de grupamentos sulfidrilas. Tem a função de mediar à lise dos vacúolos que contêm a células bacterianas, uma vez que as células mutantes não produtoras de listeriolisina são geralmente encontrados no interior destes vacúolos sendo, conseqüentemente, incapazes de se multiplicar intracelularmente.
-Fosfolipases: a L. monocytogenes produz outras duas hemolisinas a fosfatidilinositol-fosfolipase C (PI-PLC) e a fosfatidilcolina fosfolipase C (PC-PLC), que hidrolisam os lipídeos da membrana, causando ruptura da célula.
-p60: todas as cepas de L. monocytogenes sintetizam esta proteína, parece estar associada com a capacidade invasiva da bactéria, uma vez que está envolvida com a fagocitose de L. monocytogenes e mutantes rugosos apresentam uma diminuição na capacidade invasora.
-Interleucina: é uma proteína da membrana, provavelmente envolvida no mecanismo de invasão da célula do hospedeiro.
1.4. Epidemiologia
A L. monocytogenes pode ser encontrada disseminada na natureza. No homem é difícil realizar seu isolamento devido à colonização no trato intestinal. Mas já foi isolada uma grande variedade de animais gado bovino, galinhas, cachorros, lebres, peixes, larvas de insetos, dentre outros.
O primeiro suro de listerose ocorreu na década de 80 no Canadá, onde foram encontrados repolhos tipo coleslaw contaminados por L. monocytogenes. Nos EUA em 1983, ocorreu um surto que envolveu 49 indivíduos, com mortalidade de 29%, o alimento responsável foi o leite pasteurizado. Na Suíça, entre 1983 e 1987 ocorre um surto causado por queijo tipo mole, com 122 casos e 31 mortes.
A L. monocytogenes tem sido isolada em alimentos como leite cru e pasteurizado, queijos, carnes bovinas, suínas, de aves, peixes embutidos, carne moída de diferentes animais, produtos cárneos crus e termoprocessados, além de produtos de origem vegetal, de origem marinha e refeições preparadas. Isolamentos realizados em diversos países incluindo o Brasil.
Em relação à sua presença em leite pasteurizado, estudos estão sendo realizados para esclarecer a termotolerância desta bactéria. Existem duas teorias para elucidar esta questão. A primeira delas relaciona-se ao fenômeno da resposta do choque térmico: quando as células de L. monocytogenes são expostas a temperaturas sub-leteias, entre 44-48ºC, antes de serem submetidas à temperatura final de tratamento, elas apresentam um aumento de resistência térmica. A segunda teoria diz respeito à metodologia empregada para recuperação de microrganismos estressados por processamento térmico. O uso de técnicas anaeróbias para a recuperação destas células leva à recuperação de um número maior de células do que quando recuperadas na presença de oxigênio.
1.5. Medidas de controle
Para evitar a contaminação dos alimentos por L. monocytogenes, é necessárias medidas de controle no local de processamento do alimento. Sabendo que esta bactéria está amplamente distribuída e pode se desenvolver em ampla faixa de temperatura e de pH, além de ser uma das células vegetativas de maior resistência térmica, deve-se prevenir sua entrada na indústria de alimentos. Para tanto, deve-se fazer controle do microrganismo nos pontos de origem da matéria-prima através de medidas que minimizem as chances de contaminação.
Medidas que podem ser tomadas no local de produção:
- Limpeza e sanificação dos equipamentos;
- Construção de indústrias de maneira a impedir a entrada de animais, poeiras e insetos;
Evitar contato com o produto final com a matéria-prima, evitando, assim a contaminação cruzada; - Apresentação pela indústria de um setor de controle de qualidade que se aplique não somente aos parâmetros de processamento, mas também ao controle do ambiente, inclusive do pessoal.
BIBLIOGRAFIA
- FRANCO, Bernadette D. G. de Melo; Microbiologia dos Alimentos. Págs:46, 47 e 48. Atheneu. São Paulo, 2008.
- JAY, James M.; Microbiologia de Alimentos. 6ª Edição. Págs 517 a 537. Artmed. Porto Alegre, 2005
Acadêmica: Karen Quevedo
terça-feira, 16 de novembro de 2010
AS BACTÉRIAS
As bactérias são organismos procarióticos, tem uma estrutura relativamente simples, sem membrana nuclear, possui organelas. Sua parede celular é rígida, formada de peptideoglicana, e uma membrana citoplasmática, composta basicamente de fosfolipídeos e proteínas. O DNA se encontra no citoplasma, formando a região conhecida como nucleóide. Algumas espécies apresentam flagelo de locomoção, e outras, ainda, podem possuir fímbrias de adesão e pili, esta última responsável pela transferência de material genético no mecanismo de conjugação. A presença de esporos em algumas espécies fornece a elas um mecanismo de resistência, principalmente ao calor, mas também à radiação, à falta de nutrientes e à falta de umidade. Algumas bactérias que apresentam plasmídios, que são DNAs extracromossômicos, pequenos e circulares, mais comumente encontradas em bactérias Gram-negativas, apesar de não ser necessário para a sobrevivência celular ele é responsável por proporcionar uma vantagem seletiva: muitos conferem resistência a um ou mais antibiótico.
O processo mais comum de reprodução das bactérias é o de fissão binária, no qual uma célula se divide em duas. Quanto à sua nutrição, são capazes de utilizar compostos orgânicos ou inorgânicos como fonte de carbono e energia, como também, a energia luminosa, ao invés da energia química.
As bactérias podem ser encontradas no solo, água doce e nos mares, no corpo humano, nos animais, nas plantas e nos alimentos, dentre outros. Dentre os principais grupos de bactérias existentes podemos citar as mais comuns: bactérias Gram-positivas, bactérias Gram-negativas, espiroquetas, riquétsias, clamídias, micoplasmas, micobactérias, nocárdias, actinomicetos, bactérias verdes, bactérias púrpuras, e cianobactérias (fotossintéticas).
As bactérias podem ser distinguidas umas das outras por sua morfologia (tamanho, forma e característica de coloração) e por características metabólicas, antigênicas e genéticas. Apesar de ser difícil distinguir as bactérias pelo tamanho, elas tem formatos diferentes.
Uma bactéria esférica é um coco, uma bactéria em forma de bastão é um bacilo, e o treponema parecido com uma cobra é um espirilo. Além disso, espécies de Nocardia e Actinomyces tem uma aparência filamentosa ramificada. Algumas espécies formam agrupamentos parecidos com cachos de uva, como no Staphylococcus, ou como diplococos (duas células juntas) observados nas espécies de Streptococcus e Neisseria.
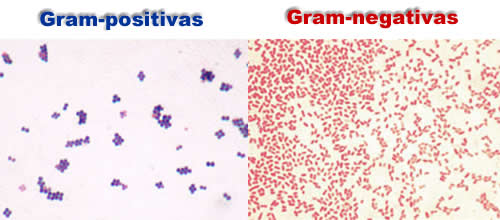
A coloração de Gram é um teste fácil e poderoso que permite distinguir entre os dois principais grupos de bactérias para direcionar um diagnóstico e terapia. As bactérias fixadas pelo calor ou, ao contrário, desidratas numa lâmina, coram com cristal violeta, um corante que forma um precipitado com o iodo; o corante não retido e em excesso é removido lavando-se com um diferenciador à base de acetona ou álcool. Um corante de contraste vermelho, a safranina, é adicionada para corar qualquer célula descorada. Este processo leva menos de 10 minutos.
Para bactérias Gram-positivas, que se tornam um azul violeta, o corante fica confinado numa estrutura grossa, entrecruzada e com aspecto de uma malha, a camada de peptidoglicano que circunda a célula. As bactérias Gram-negativas possuem uma fina camada de peptideoglicano que não retém o corante cristal violeta: por isso a célula deve ser contratada com a safranina, tornando-se vermelha.
As bactérias que não podem ser classificadas pela coloração de Gram incluem as micobactérias, que possuem um envoltório externo céreo e são diferenciadas com um corante álcool-ácido-resistente, e o micoplasmas, que não possuem peptidoglicano.

 COLORAÇÃO DE GRAM
COLORAÇÃO DE GRAMA estrutura, os componentes e as funções da parede celular distinguem as bactérias Gram-positivas das Gram-negativas. Os componentes da parede celular também são únicos para as bactérias, e sua estrutura repetitivas desencadeia as respostas imunes inatas protetoras dos seres humanos.
As bactérias Gram-positivas possuem uma parede células grossa e de múltiplas camadas consistindo principalmente de peptideoglicano envolvendo a membrana citoplasmática. O peptideoglicano é um exoesqueleto em forma de malha funcionalmente, é poroso e permite a difusão dos metabólitos para a membrana plasmática. O peptideoglicano é essencial para a estrutura, a replicação e a sobrevivência em condições normalmente hostis nas quais as bactérias crescem. Durante a infecção, o peptidoglicano pode interferir na fagocitose e estimular respostas inatas, incluindo a atividade pirogênica.
O peptideoglicano pode ser degradado pelo tratamento com lisozimas. A lisozima degrada a espinha dorsal de glicano do peptidoglicano. Sem o peptideoglicano, a bactéria sucumbe à grande diferença de pressão osmótica na membrana citoplasmática e se rompe. A remoção da parede celular produz um protoplasto que se rompe a menos que seja estabilizado osmoticamente.
A parede celular das bactérias Gram-positivas pode conter outros compostos tais como os ácidos teicóicos (essencial para a viabilidade da célula) e lipoteicóicos (são moléculas antígenos comuns de superfície que distinguem os sorotipos bacterianos e promovem a agregação a outras bactérias e a receptores específicos nas superfícies celulares dos mamíferos, importantes na virulência bacteriana) e complexos polissacarídios.
As bactérias Gram-negativas possuem uma parede celular com uma fina camada de peptideoglicano, e externamente à camada de peptideoglicanos está à membrana externa, presente somente em bactérias Gram-negativas. A área externa da membrana citoplasmática e a superfície interna da membrana externa é a chamada de espaço periplasmático. Neste espaço existe um compartilhamento contendo uma variedade de enzimas hidrolíticas que são importantes para a célula na quebra de grandes moléculas para o metabolismo. Essas enzimas incluem as proteases, fosfatases, lípases, nucleases e enzimas de degradação de carboidratos. As espécies Gram-negativas patogênicas, muitos dos fatores líticos de virulência, como as colagenases, hialuronidases, proteases e β-lactamases estão no espaço periplasmático. Neste espaço contém componentes do sistema de transporte de açúcares e outras proteínas de ligação para facilitar a obtenção de diferentes metabólitos e outros compostos.
A membrana externa das bactérias Gram-negativas é como um firme saco de lona em torno da bactéria. Ela é responsável de manter a estrutura bacteriana e é uma barreira de permeabilidade para moléculas grandes e moléculas hidrofóbicas. Ela também confere a proteção contra condições ambientais adversas como do sistema digestivo do hospedeiro. A membrana externa possui uma estrutura assimétrica com duas camadas, com um folheto interno e externo. O folheto interno contém fosfolipídios e o folheto externo é composto de uma molécula anfipática (possui ambas as terminações hidrofóbica e hidrofílica) chamada de lipopolissacarídio (LPS).
O LPS é também chamado de endotoxina, um poderoso estimulador de respostas naturais e imunes. O LPS ativa as linfócitos B e induzem macrófagos, células dendríticas e outras células para a liberação de interleucinas 1 e 6, o fator de necrose tumoral e outros fatores. O LPS provoca febre e pode causar choque. A reação de Shwartzman (coagulação intravascular disseminada) segue a liberação de grandes quantidades de endotoxina na corrente sanguínea. O LPS é liberado das bactérias para o meio e para o hospedeiro.
ESTRUTURAS EXTERNAS
Algumas bactérias (Gram-positivas ou Gram-negativas) são envolvidas por camadas frouxas de polissacarídios ou proteínas chamadas cápsulas. Quando são pouco aderentes e de densidade ou espessura não uniforme, são chamadas de camada viscosa. As cápsulas e as camadas viscosas também são chamadas de glicocálice.
Cápsula e camadas viscosas são desnecessárias para o crescimento das bactérias, mas são muito importantes para a sobrevivência no hospedeiro. A cápsula é fracamente antigênica e antifagocítica e é um fator de virulência de grande importância. A cápsula também pode agir como uma barreira para moléculas hidrofóbicas tóxicas, tais como os detergentes, e podem promover a aderência a outras bactérias ou aos tecidos superficiais do hospedeiro.
Algumas bactérias produzem um biofilme de polissacarídios sob certas situações adversas, o qual estabelece uma comunidade de bactérias e a protege dos antibióticos e das defesas do hospedeiro.
Os flagelos são propulsores do tipo trança compostos por subunidades protéicas acopladas na forma helicoidal que ficam ancoradas nas membranas das bacterianas por estruturas chamadas de corpo basal em forma de gancho, e são direcionadas pelo potencial de membrana. As espécies bacterianas podem ter um ou vários flagelos em suas superfícies, e estes podem estar ancorados em diferentes partes da células. Os flagelos proporcionam mobilidade à bactéria, permitindo à célula nadar (quimiotaxia) em busca de alimento e para longe dos “venenos”.
As fímbrias são estruturas que parecem cabelos no lado de for da bactéria, e estão arranjadas uniformemente sobre toda a superfície da células bacteriana. As fímbrias promovem aderência a outras bactérias ou ao hospedeiro.
- MURRAY, Patrick R. Microbiologia Médica. 5ª Edição. Editora: Elsevier. Rio de Janeiro, 2006.
- VERMELHO, Alane B, [et al]. Práticas de Microbiologia. 1ª Edição. Editora: Guanabara Koogan. Rio de Janeiro, 2006.

