segunda-feira, 28 de março de 2011
CARACTERÍSTICAS GERAIS DA INFLAMAÇÃO
domingo, 27 de março de 2011
CIENTISTAS DESCOBREM UMA CÉLULA DO CORPO QUE "AJUDA" O CÂNCER

quinta-feira, 24 de março de 2011
BLOQUEIO AO HIV

De acordo com o responsável pela pesquisa, Carl June, o tratamento envolve retirar as células mais propensas à infecção por HIV, chamadas CD4+, de um paciente soropositivo. Em seguida, elas são alteradas em laboratório para “sabotar” um gene chamado CCR5, que é a “porta de entrada” do vírus causador da Aids. As células tratadas ficam, então, “trancadas” para o HIV. Depois da mudança, elas são recolocadas no paciente.“Este é o primeiro exemplo de modificação genética a introduzir um gene resistente a doenças em um paciente”, disse June.
Os resultados preliminares revelaram que, um ano após o tratamento, as células alteradas cresceram em número. Em alguns pacientes, as células haviam colonizado áreas do intestino e da mucosa retal, onde o HIV geralmente se multiplica e as CD4+ se esgotam. O estudo foi considerado pioneiro e apresentado esta semana em uma conferência sobre vírus em Boston.
sexta-feira, 25 de fevereiro de 2011
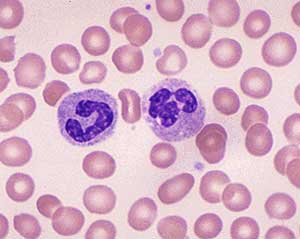
Leucócitos
quarta-feira, 23 de fevereiro de 2011
LESÃO
Bibliografia
FILHO, Geraldo B; Bogliolo Patologia. 7ª Edição. Pgs 3 e 4. Guanabara Koogan. Rio de Janeiro, 2006.
sexta-feira, 21 de janeiro de 2011
Diagnóstico Imunológico de HTLV TIPO I e II e Lupús Eritematoso
O vírus linfotrópico para células T humanas tipo I (HTLV-I) foi descoberto em 1980, isolado de células derivadas de paciente com linfoma cutâneo e mais tarde relacionado à leucemia/linfoma de células T do adulto (ATL), doença descrita três anos antes no Japão. Pouco depois da descoberta do HTLV-I, em 1982 foi isolado outro retrovírus, o HTLV-II, isolado através de células esplênicas de paciente variante de leucemia. O HTLV-II tem semelhança com o HTLV-I em 66% das seqüências genômicas, havendo reações sorológicas cruzadas entre eles.
O aumento do número de células infectadas é a principal estratégia para a elevação da carga viral, de modo que a carga viral do HTLV-I/II é proporcional ao número de células infectadas.
A maior parte dos indivíduos infectados por HTLV-I ou HTLV-II permanece assintomáticos por toda sua vida, sabe-se que o HTLV-I é responsável por pelo menos duas síndromes: Leucemia/linfoma de células T do adulto (ATL/L) e uma mielopatia crônica, conhecida como paraparesia espástica tropical ou mielopatia associada ao HTLV-I (HAM/TSP). Ainda não é conhecido o mecanismo oncogênico que determinam a evolução de indivíduos infectados com HTLV-I para o quadro de ATL/L. Mas sabe-se que os linfócitos infectados passam a expressar marcadores celulares de superfície, característicos de estado de ativação celular, podendo exibir proliferação celular espontânea. Considerando que a proteína viral p40tax apresenta ação transativadora sobre genes celulares relacionados à proliferação celular, admite-se que esta possa ter um papel importante na transformação celular dos linfócitos infectados.
A agressão ao tecido nervoso no quadro de HAM/TSP pode ocorrer devido a dois mecanismos:
- Citotoxicidade de linfócitos CD8+ sensibilizados a proteínas virais sobre células gliais infectadas ou células CD4+ infectada;
- Auto-imunidade: agressão de clones proliferados de células CD4+ infectados por HTLV-I à proteína básica da mielina por ação tóxica de citocinas.
1.1 Manifestações Clínicas
1.1.1 Leucemia/linfoma de células T do adulto (ATL/L)
A ATL/L apresenta-se sob diferentes formas clínicas:
Aguda: com adenomegalia generalizada, hepatoesplenomegalia, lesões osteolíticas, hipermalcemia e frequentemente manifestações cutâneas. No sangue periférico é encontrado elevado número de linfócitos atípicos, exibindo núcleos multilobulados (células ATL).
Crônica: linfonodomegalia e hetoesplenomegalia, acompanhadas de leucocitose. Presença de tosse, alterações cutâneas, calcemia. Presença de linfócitos atípicos de no máximo 10%.
Indolente: com manifestações exclusivamente dermatológicas. Evolução lenta. Presença de células ATL em 0,5% a 3%.
Linfomatosa: com linfonodomegalia acentuada, sem células atípicas em sangue periférico.
1.1.2 Paraparesia Espástica tropical ou mielopatia associada ao vírus HTLV (HAM/TSP)
É uma doença desmielinizante progressiva crônica que causa danos principalmente no cordão torácico-espinhal, e é mais freqüente nas mulheres. Os sintomas iniciais são fraqueza e rigidez dos membros inferiores.
Ainda não se sabe se a maior parte dos danos neurológicos ocorre no primeiro ano e infecção; indivíduos que após três anos do aparecimento dos sintomas inicias desenvolvem um quadro de paralisia unilateral, o tempo médio ate o confinamento em cadeira de rodas é de quatro anos.
Na leucemia de célula T pilosa, o DNA proviral HTLV-1 é encontrado predominantemente em células TCD8+, diferentemente do que se observa na leucemia pelo HTLV-1, em que são encontrados 90 a 99% do provírus em células TCD4+ CD8+.
1.1.3 Manifestações relacionadas ao HTLV-II
Embora tenha sido isolado em um paciente com leucemia atípica, não existe evidencia que seja o agente etiológico responsável. Mas casos recentes tem mostrado a participação do HTLV-II em casos de mielopatia crônicas, semelhantes ao HAM/TSP. Ainda existem evidências do HTLV-II em infecções com polineuropatias e quadros de mielopatia inflamatória.
1.2 Diagnóstico
O diagnóstico para HTLV-I/II é baseado na detecção sorológica de anticorpos circulantes específicos voltados a constituintes antigênicos das diferentes porções dos vírus. Como as infecções causadas por HTLV-I/II são de natureza perene, achado de anticorpos circulantes especificamente voltados a constituintes antigênicos virais indica o estado de portador da infecção.A triagem para o HTLV utiliza reações de aglutinação em látex sensibilizada ou por ensaio imunoenzimático (ELISA), embora apresentem alta sensibilidade e especificidade, tais técnicas, quando empregadas em situações de rastreamento em populações de baixa prevalência infecciosa podem exibir baixo valor preditivo positivo e apresentar freqüentes reações falsas positivas. Por isso o diagnóstico exige confirmação através de Western blot.
Devido à semelhança entre os HTLV-I e HTLV-II ocorre reações cruzadas entre eles nos testes sorológicos realizados, assim se os indivíduos forem soropositivos são identificados como soropositivos para HTLV I/II, porém não se sabe qual é o HTLV é responsável pela infecção. Por ser necessário saber o tipo de HTLV causador, para melhor aconselhamento clínico ao paciente, realiza Western blot para identificar o tipo de HTLV.
2. LÚPUS ERITEMATOSO
O Lúpus Eritematoso é uma doença auto-imune reumática. Onde o colágeno pode assumir dupla importância: como alvo de reações auto-imunes e como tecido conjuntivo produzido em excesso. Existem dois tipos de Lúpus Eritematoso. O Lúpus Eritematoso Bolhoso (LEB) que é uma doença vesicante epidérmica, caracterizada pela presença de auto-anticorpo para o colágeno de tipo VII. E o Lúpus Eritematoso Sistêmico (LES) que é uma doença multissistêmica, caracterizada pela presença de múltiplos auto-anticorpos, incluindo os anticorpos antinucleares, anti-DNA natural, anti-histonas e anti-Sm.
2.1 Lúpus Eritematoso Bolhoso (LEB)
É uma doença vesicante epidérmica caracterizada pela presença caracterizada pela presença de auto-anticorpo para o colágeno de tipo VII na proteína da zona da membrana basal (ZMB). Os pacientes acometidos com uma combinação de vesículas, erosões, escaras, miliária e despigmentação da pele, mais comumente nas superfícies cutâneas extensoras expostas ao traumatismo, como joelhos, cotovelos e dorso das mãos e dos pés. Está sintomatologia também ocorre na Epidermólise Bolhosa Adquirida (EBA), então para realizar diagnóstico da doença é necessário exame laboratorial. Lembrando que o LEB também ocorre em pacientes com lúpus eritematoso sistêmico.
2.1.1 Diagnóstico
O diagnóstico deve ser confirmado com exames laboratoriais. Que podem ser:
- Por microscopia de imunoflurescência direta, os pacientes com LEB apresentam imunorreativos lineares na ZMB que mais comumente consistem IgG e C3. Por meio de biópsia direta da pele separada por cloreto de sódio, os imunorreativos lineares são localizados no aspecto dérmico, ou assoalho, da úlcera produzida;
- Por microscopia de imunoflurescência indireta, existe uma dificuldade na localização de auto-anticorpos demonstráveis quando a pele humana está sem tratamento com sal. Os auto-anticorpos circulantes podem ser identificados em 50% a 85% dos pacientes quando é realizada a técnica da biópsia direta tratada com sal.
2.2 Lúpus Eritematoso Sistêmico
O Lúpus Eritematoso Sistêmico é uma doença multissistêmica que segue um curso flutuante, com exacerbações e remissões espontâneas. É identificada por suas manifestações clínicas e por uma variedade de auto-anticorpos circulantes. Em particular, os auto-anticorpos dirigidos contra componentes do núcleo celular desempenham importante papel diagnóstico e patogênico. O LES afeta 40 em 100.000 indivíduos da Europa setentrional ou caucasianos americanos. A incidência parece ser maior na população negra e ainda maior em orientais.
2.2.1 Patogenia
O quadro patogênico do LES relaciona-se fatores ambientais que interagem com genes de suscetibilidade, produzindo uma resposta imunológica hiperativa e auto-agressiva: os principais efetores da lesão tecidual consistem em auto-anticorpos imunocomplexos.
Com as acentuadas semelhanças entre um vírus e os alvos dos anticorpos encontrados no LES, uma das explicações mais freqüentes para o mecanismo de desenvolvimento da doença consiste num processo que envolve o mimetismo molecular entre microorganismos e os constituintes “próprios”. Os auto-anticorpos encontrados LES são produzidos por linfócitos B que sofreram rearranjos gênicos e mutações somáticas típicos de uma resposta desencadeada por um antígeno. Parece haver também uma desregulação generalizada dos linfócitos B, resultando na produção de grandes quantidades de auto-anticorpos, os quais lesam as células e tecida através de sua ligação direta às membranas celulares ou da formação de imunocomplexos que se depositam.
O papel lesivo dos auto-anticorpos antiplaquetários na trombocitopenia, observado em paciente com LES, encontra-se bem estabelecido, enquanto foram implicados dos auto-anticorpos antineuronais nas manifestações neurológicos do lúpus. Os anticorpos antilinfócitos não apenas são responsáveis pela linfopenia generalizada observada no lúpus, como também pela depleção seletiva dos linfócitos T imunorreguladores, cujo papel é restringir as reações auto-imunes. E após, estabelece um círculo vicioso de imunorregulação deficiente, auto-imunidade, anticorpos antilinfócitos e deficiência da imunorregulação.
Os auto-anticorpos anticardiolipina-circulantes são agentes patológicos adicionais; reagem com componentes fosfolipídicos (dos quais a cardiolipina é um dos principais) e estão envolvidos na trombose arterial e venosa, bem como no aborto espontâneo
Os imunocomplexos de auto-anticorpo e auto-antígeno alojam-se em tecidos altamente vascularizados, como o glomérulo renal. A potogenicidade destes complexos aumenta com a crescente capacidade do anticorpo de fixar o complemento: o tamanho dos complexos, a sua carga e depuração (que depende de receptores de C4 e do complemento funcionais) é importante por influenciar a deposição nos tecidos.
O número de CR1 (receptor do complemento 1) é reduzido na superfície dos eritrócitos de pacientes com lúpus: tal defeito, que costuma ser adquirido, mas é, algumas vezes, herdado no SLE, impede a liberação de toda a carga de imunocomplexos ao sistema mononuclear fagocítico no interior do fígado e do baço. A natureza catiônica do DNA nos imunocomplexos do lúpus facilita a ligação às paredes capilares no interior do glomérulo.
2.2.2 Manifestações clínicas ou conseqüências no organismo
O LES é uma doença multissistêmica que pode afetar quase todos os órgãos. Sendo algumas manifestações habituais e outras raras. A gravidade das manifestações clínicas é variável e alteram conforme os períodos de relativa quiescência.
Manifestações musculoesqueléticas: Artralgias e artrite, de natureza migratória, afeta praticamente todos os pacientes. Raro haver lesão na coluna.
Manifestações cutâneas: eritema malar sobre as bochechas e a ponte do nariz é típico, porém ocorre em um terço dos pacientes. Freqüente em áreas expostas aos sol (pescoço, braço, pernas)
Manifestações renais: grande parte dos pacientes apresenta depósitos de imunoglobulinas nos glomérulos, apresentando um glomerulonefrite (presente em 50% dos casos), incluindo uma doença profilerativa focal leve até uma doença proliferativa difusa agressiva.
Manifestações neurológicas: Pode ser afetada qualquer região do SNC, e as manifestações vão desde psicose e convulsões até síndromes cerebrais orgânicas.
Manifestações cardiopulmonares: pode ocorrer pericardite, anormalidade valvulares, derrame pleural também é comum.
Manifestações vasculares: estas complicações afetam vasos de qualquer calibre, encontrado geralmente associado a anticorpos antifosfolipídios. A vasculite retiniana constitui uma grave manifestação ocular.
2.2.3 Manifestações imunológicas laboratoriais
O anticorpo antinuclear (ANA) constitui a característica soro-imunológico essencial do LES. Com o decorrer do tempo, é certo considerar que todos os pacientes com LES irão apresentar este anticorpo no soro. O ANA é detectado utilizando a técnica de imunoflurescência indireta, na qual o soro diluído do paciente é aplicado a uma preparação tecidual- ou preparação de células-, em que os núcleos são proeminentes.
Quatro padrões de ANA podem ser facilmente reconhecidos na imunoflurescência:
1° Padrão homogêneo: este padrão é produzido por um anticorpo dirigido contra proteínas relacionadas às DNA, as histonas;
2° Padrão heterogêneo: este padrão corresponde a uma variedade de anticorpos dirigidos contra outros antígenos no núcleo. Estes antígenos foram coletivamente denominados antígenos nucleares extraíveis (ENA) e são normalmente detectados por imunodifusão ou por técnicas de ELISA.
3° Padrão periférico: tradicionalmente, o padrão periférico de coloração do ANA corresponde ao anti-DNAdf, embora este aspecto seja controvertido. Os anticorpos dirigidos contra proteínas do envoltório nuclear, como as lâminas, também são responsáveis pelo padrão periférico.
4° Padrão nucleolar: este padrão nucleolar é raro no LES, sendo mais associado à esclerose sistêmica.
O ANA é um teste muito sensível para LES, e sua presença, frequentemente em altos títulos, é observada em praticamente todos os pacientes. A especificidade em relação LES é relativamente baixa, devido a este anticorpo estar presente em outras doenças reumáticas, como na hepatopatia auto-imune, nas infecções virais e, em certas ocasiões, nos indivíduos normais em baixos títulos.
2.2.4 Diagnóstico
O LES é um distúrbio caracterizado sorologicamente pela presença de múltiplos auto-anticorpos, incluindo os anticorpos antinucleares, anti-DNA natural, anti-histonas e anti-Sm. Por meio de microscopia de imunoflurescência direta (MIFD) pode-se observar depósitos granulares e contínuos de imunoglobulina e complemento ao longo da zona da membrana basal (ZMB) epidérmica em 50% a 95% dos pacientes com LES. Os depósitos na ZMB do complexo de ataque à membrana do sistema complemento, C5b-9, na pele lesional podem ser um marcadores de LES. Embora os depósitos de IgG, IgM e de componentes do complemento (C3 e/ou C1q) sejam mais comumente encontradas nesse pacientes, pode haver deposição de imunoglobulinas de todas as demais classes. Quando a pele não lesional apresenta concomitantemente as imunoglobulinas IgG, IgA e/ou IgM no padrão típico, o diagnóstico de LES é fortemente sugestivo.
Embora característica, essa reação também é encontrada em distúrbios como doença mista do tecido conjuntivo. Portanto, é de fundamental importância o estabelecimento de uma correlação dos resultados por MIFD com a apresentação clínica e os resultados das biópsias de pele sob microscopia óptica desses pacientes. As informações devem ser interpretadas no contexto de achados diretos do paciente individual a fim de classificar o tipo clínico de LES.
BIBLIOGRAFIA:
LIVROS:
- PEAKMAN, Mark. Imunologia Básica e Clínica. 2ª Edição. Guanabara Koogan. Rio de Janeiro,1999.
- HENRY, John B; Diagnósticos clínicos e tratamentos por métodos laboratoriais. 20ª Edição. Manole, 2008.
- SHARON, Jacqueline. Imunologia Básica.1ª Edição. Guanabara Koogan. Rio de Janeiro,2000.
- FOCACCIA, Robert. Veronesi: Tratado de Infectologia. Vol. 1. 3ª Edição. Atheneu. São Paulo, 2006.
INTERNET:
- BITTENCOURT, Achiléa L. [et al]. Leucemia/ linfoma de células T adulto. Acesso: www.scielo.br
segunda-feira, 22 de novembro de 2010
DIAGNÓSTICO IMUNOLÓGICO PARA TOXOPLASMOSE E RUBÉOLA
1. TOXOPLASMOSE
1.1 Doença e Manifestações clínicas
A Toxoplasmose é uma doença parasitária infecciosa, onde seu agente casual é o Toxoplasma gondii, um parasito intracelular, capaz de infectar tanto mamíferos como aves, inclusive o homem. Todas as fases do ciclo de vida ocorrem nos felinos, mas somente os estágios de trofozoíto e cisto ocorrem em humanos e outros hospedeiros intermediários.
A transmissão ocorre pela ingestão de carne mal cozida, que contém cistos teciduais, ou pela ingestão de oocistos infectantes em alimentos ou água contaminada com fezes de gatos. A doença a maioria das vezes é assintomática. Possui larga distribuição geográfica ocorrendo tanto em países desenvolvidos como em desenvolvimento. A infecção nas pessoas imunocomprometidas pode apresentar complicações graves. A infecção in útero pode resultar em infecção congênita grave com seqüelas ou natimortos.
A maioria das infecções agudas é assintomática ou mimetiza outras doenças infecciosas, nas quais febre linfodenopatia são proeminentes. A infecção congênita pode ocorrer quando a mãe desenvolve a infecção aguda durante a gestação. O risco de infecção de recém-nascido não está relacionado à presença ou ausência de sintomas na mãe, mas a gravidade da infecção depende do período de gestação em que o contágio ocorre. Morte intra-uterina, microcefalia ou hidrocefalia com calcificação intracraniana podem ocorrer quando a infecção é adquirida na primeira metade da gestação. As infecções na segunda metade da gestação geralmente são assintomáticas ao nascimento, embora febre, hepatosplenomegalia e icterícia possam aparecer. Coriorretinite, retardo psicomotor e distúrbios convulsivos podem se manifestar meses ou anos depois.
Em indivíduos imunossuprimidos, especialmente aqueles com AIDS, apresentam infecções do SNC. Outras manifestações clínicas e patológicas incluem pneumonite, miocardite, renite, pancreatite ou orquite.
1.2 Diagnóstico Imunológico
Existem outros métodos de diagnóstico, mas o imunológico ainda é o mais realizado. A sorologia continua sendo a principal abordagem no diagnóstico da toxoplasmose.
O teste com o corante de Sabin-Feldman e o ensaio de IF (imunofluorescência) são padrões com os quais os demais métodos são comparados, embora o primeiro seja realizado em poucos centros. Os teste de EIA (ensaio imunoenzimático) estão comercialmente disponíveis e resultados são semelhantes a IF.
Os teste para anticorpos IgM específicos são especialmente úteis para o diagnóstico de infecção congênita e aguda, mas o conhecimento das limitações do exame, particularmente da ocorrência de reações falso-positivas, é extremamente importante. A persistência de anticorpos IgM específicos, algumas vezes por um ano ou mais, também, é problemática e deve ser interpretada em conjunto com os resultados da dosagem de anticorpos IgG. Tendo em vista que muitas pessoas apresentam infecção assintomática, títulos baixos de IgG é de pouco significado. Os títulos em pacientes com infecções oculares crônicas também pode estar baixo.
Pacientes imunocomprometidos, aqueles com AIDS, apresentam anticorpos IgG preexistentes específicos, embora os títulos possam ser baixos, e raramente é observada IgM. A interpretação dos títulos de IgM e IgG varia conforme a metodologia do teste e o fabricante. O laboratório que realiza o exame deve fornecer os critérios necessários para a interpretação
2. RUBÉOLA
A rubéola (sarampo alemão) geralmente produz uma febre branda e uma erupção transitória em crianças e em adultos. O vírus da rubéola circula pela via hematogênica, mesmo nos casos brandos, e a disseminação virêmica transplacentária durante o primeiro trimestre da gravidez pode produzir má formação teratogênicas cardíacas, oculares e cerebrais desvastantes.
Quando há suspeitas de rubéola aguda em uma mulher grávida, o método mais direito e seguro de diagnóstico consiste em detectar os anticorpos IgM anti-rubéola no soro da mulher, por ELISA ou IFA.
O método de ELISA é o mais realizado devido sua sensibilidade e facilidade, sendo realizado da seguinte forma:
1º PASSO: Colocar o soro do paciente em placas de microtitulação sensibilizadas com anticorpo reagente, se o soro apresentar antígeno se ligará ao anticorpo da fase sólida (ELISA captura), um segundo anticorpo é conjugado com uma enzima e é colocado no poço tendo a capacidade de se ligar ao antígeno;
2º PASSO: Após o segundo anticorpo ser adicionado, será realizada uma lavagem para eliminar os anticorpos não ligados, depois é adicionado o substrato da enzima que irá reagir produzindo um produto colorido que é verificado em espectrofotometria.
BIBLIOGRAFIA
- HENRY, John B; Diagnóstico clínicos e tratamentos por métodos laboratoriais.
20ª Edição. Manole, 2008; - COURA, Dinâmica das Doenças Infecciosas e Parasitárias, 2º volume. Guanabara Koogan, 2005.
ACADÊMICA:
Karen Quevedo
quarta-feira, 10 de novembro de 2010
1. HEPATITES VIRAIS (A E B): DIAGNÓSTICO IMUNOLÓGICO E A RELAÇÃO DA IgM E IgG COM A PRESENÇA DA DOENÇA
quarta-feira, 20 de outubro de 2010
REAÇÕES DE HIPERSENSIBILIDADE E ALERGIA
Em outros casos, o estimulo desencadeante é uma molécula inócua, ignorada pelo sistema imunológico da maioria dos indivíduos, porém capaz de iniciar, em alguns, uma resposta imunológica que produz lesão tecidual e, até mesmo, a morte do hospedeiro. Estas reações exageradas e inapropriadas são descritas pelo termo reações de hipersensibilidade.
A resposta alérgica possui diversos componentes: o alérgeno, o estado de reatividade do hospedeiro e as influências genéticas e ambientais. Nos últimos anos, se tornaram evidentes que as manifestações não dependem somente da desgranulação dos mastócitos e reação de hipersensibilidade imediata.
Os distúrbios alérgicos também se caracterizam por uma conseqüência que ocorre através de vários dias de exposição ao um mesmo fator alérgico. E estas reações imunológicas procedem no resultado indireto na desgranulação dos mastócitos possuindo implicações patogênicas e clínicas.
A alergia significa reatividade alterada, é um termo utilizado com demasiada freqüência. A alergia pode ser definida como um estado de maior reatividade do sistema imunológico a substância estranhas. O uso do termo “alérgico” será restrito as reações iniciadas, quando a IgE ligada aos mastócitos interage com seu antígeno-alvo, conhecido como alérgeno. As doenças alérgicas que provocam maior morbidade e mortalidade são a asma, uma doença pulmonar crônica; a rinite alérgica (a rinite alérgica sazonal é a “febre de feno”); o eczema e a urticária (distúrbios cutâneos); e a anafilaxia generalizada.
A tendência a reações alérgicas possui forte componente hereditário, tendo sido denominada atopia, mais facilmente definida pela presença de uma reação de hipersensibilidade do tipo 1contra um alérgeno, geralmente demonstrado no teste cutâneo de escarificação; tal estado potencialmente alérgico não precisa resultado em doença. Dois, um ou nenhum dos pais atópicos transmitem o caráter atópico a seus filhos com um risco de 75%%, 50% e 15%, respectivamente e 20% a 30% da população exibem atopia.
A natureza daquilo que é exatamente herdado pelos indivíduos atópicos e, por conseguinte, dos componentes que predispõem a alergia é complexa.
Os fatores ambientais desempenham claramente um papel. A prevalência da asma, do eczema e da rinite alérgica duplicou em crianças de 12 anos de idade numa comunidade do sul de Gales entre 1973 e 1988, sem qualquer alteração fundamental na constituição genética dos habitantes. A asma é mais comum na segunda geração de imigrantes das índias Ocidentais nascidos no Reino Unido em comparação com os pais criados no exterior, Conforme assinalado é possível que o ambiente comece a ter um efeito durante a vida fetal.
A alergia é uma doença suficientemente comum e emocional, para que, à medida que vão sendo propostos ou identificados mais fatores ambientes predisponentes, as famílias de alto risco passem a modificar seu comportamento. Por conseguinte, é importante que haja pesquisas contínuas, a fim de examinar tais associações.
Existem 4 tipos básicos de reações alérgicas ou mecanismos imunológicos causadores de hipersensibilidade e doença:
Aproximadamente dois terços dos indivíduos atópicos, definidos pela obtenção de um resultado positivo no teste cutâneo com alérgenos, apresentam doença alérgicas clínica, cuja prevalência é de 15% a 20%. Ambos os sexos são igualmente afetadas. As reações alérgicas vão desde uma irritação mínima até uma condição potencialmente fatal. Em certas ocasiões, produzem morte, geralmente em decorrência da asma e, mais raramente, de picadas de vespas e abelhas, ou alergia alimentar. A doença alérgica é responsável por até um terço das ausências na escola devido à doença crônica, estimando-se que uma das doenças mais comuns, a asma, seja responsável pela morte de duas mil pessoas no Reino Unido anualmente, das quais 40 a 45 são crianças.
O diagnóstico de doença alérgica é estabelecido durante a anamnese, ocasião em que se torna possível efetuar uma boa estimativa sobre a natureza dos alérgenos. O momento da ocorrência pode estar relacionado com uma alergia sazonal ou exposição à poeira doméstica, ou histórico familiar, exposição a animais o fator desencadeante é desconhecido.
Geralmente, efetua-se um teste cutâneo contra um amplo painel de antígenos, com resultados quase sempre positivos. Em sertãs ocasiões, os testes cutâneos revelam sensibilização a alérgenos não reconhecidos pelo paciente, o que pode ajudar a evitá-los.
O tratamento de primeira linha consiste evitar o alérgeno, sendo esta medida seguida do uso de fármacos. Em algumas doenças alérgenas, a opção final pode consistir em dessensibilização (também denominada hipossensibilização ou imunoterapia).
Medidas preventivas como armazenar e trocar roupas de cama para evitar ácaros, limpeza regular, evitar o contato com substâncias alérgicas ajudam a evitar crises alérgenas.