quarta-feira, 22 de maio de 2013
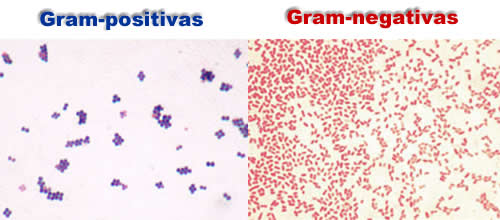
Colorações

terça-feira, 22 de novembro de 2011
URINÁLISE
A quantidade de urina normalmente produzida por um adulto é de aproximadamente de 600 mL a 2.000 mL por dia, a urina noturna raramente excede a 400 mL. A formação da urina ocorre nos rins que filtra um grande volume de líquido do sangue no glomérulo (filtrado glomerular) para os túbulos (urina primária). Além da água, o qual contém pequenas moléculas presentes no plasma e em seguida, no túbulo e no ducto coletor, transporta de volta pra o sangue (reabsorção) os componentes da urina primária em quantidades diferentes conforme a substância bem como conforme a necessidade (regulação). E o restante do filtrado é eliminado com a urina (excreção) (SILBERNAGL; DESPOPOULOS, 2009).
Hoje, a urinálise faz parte da rotina laboratorial e é um trabalho que faz parte da capacidade biomédica. Existem atualmente três tipos importantes de urinálise: 1- A Fita reagente (dipstick) que proporciona múltiplas informações fisioquímicas da urina; 2- urinálise básica que utiliza o exame microscópico do sedimento urinário junto com a fita reagente; 3- e o exame citopatológico especializado do sedimento urinário. Utilizando a parte química e microscópica de um laboratório (HENRY, 2008).
Uma avaliação urinária consiste em dois componentes importantes: (1) determinações fisioquímicas (densidade, aspecto, cor e outras determinações da fita reagente); (2) exame microscópico para evidenciar hematúria, piúria, cilindros (cilindrúria) e cristalúria.
E uma urinálise de rotina observa-se quatro componentes: avaliação da amostra, exame superficial/físico, triagem bioquímica e exame do sedimento.
Na avaliação da amostra é observado se ela está devidamente identificada, se tem condições para o exame solicitado, conservação adequada e se ela num apresenta sinais de contaminação. O exame físico analisa o aspecto, cor, densidade e volume. A triagem bioquímica avalia o pH, proteinúria, glicose e outros açúcares, presença de cetonas, hemoglobina, bilirrubina, presença de nitrito e leucócitos na urina. A avaliação do sedimento deve ser feita com microscopia óptica e os resultados devem ser interpretados juntamente com o exame bioquímico e físico.
Uma análise urinária completa apresenta uma avaliação através de fita reagente, densidade específica e observação do sedimento urinário, esta análise pode auxiliar o clínico a visualizar problemas quando o paciente for assintomático, assim preconizando o diagnóstico e proporcionando uma melhor sobrevida ao paciente. Uma urinálise realizada de forma correta realiza a combinação da análise física, química e o histórico do paciente, assim podem incluir ou excluir diversas patologias, proporcionando um diagnóstico diferencial (DALMOLIN, 2011).
CONCLUI-SE QUE...
A urinálise é um exame muito importante na rotina laboratorial, pois ele avalia a presença de processos patológicos renais (infecções e insuficiências renais), auxiliando no diagnóstico de diversas patologias, permitindo um monitoramento e a visualização de um progresso destas patologias. Além de permitir a verificação da eficácia de tratamentos.
A metodologia pode ser realizada da seguinte forma:
1º é realizado a análise físico-química da urina coma fita reagente. Nela é permitida a visualização da cor, da densidade, do aspecto, volume, pH, glicose, uribilinogênio ou bilirrubina, presença de leucócitos, nitrito, proteínas, cetonas, hemoglobina na urina. São realizadas anotações que auxiliaram na fase de visualização dos sedimentos.
Onde primeiramente são visualizadas as características físicas da urina:
-Cor: normalmente a urina apresenta uma coloração transparente e amarelada. Nunca deve ser considerado como um fator característico de patogenia deve ser associado com os outros resultados. Podendo ser encontradas a cor amarela clara, amarelo citrino e amarelo escuro.
-Turbidez: é influenciada pela concentração urinária. Leucócitos, eritrócitos, cristais, bactérias, muco, lipídeos e materiais contaminantes podem aumentar a turbidez da amostra. A turbidez pode apresentar as seguintes classificações: turvo, levemente turvo ou límpido.
-Densidade: A densidade indica a concentração das substâncias sólidas diluídas na urina. Quanto menos água houver na urina, menos diluída ela estará e maior será sua densidade. Urina com densidade próxima de 1030 indica desidratação. São muito amareladas e normalmente possuem odor forte.
-Volume: observa o volume de urina apresentado pelo paciente.
E com a fita reagente são obtidos as características químicas. Que são:
-pH: A urina é naturalmente ácida, pois o rim é o principal meio de eliminação dos ácidos do organismo. Valores maiores ou igual 7 podem indicar presença de bactérias que alcalinizam a urina. Valores menores que 5,5 podem indicar acidose no sangue ou doença nos túbulos renais.
-Glicose: Toda a glicose que é filtrada nos rins, é reabsorvida de volta para o sangue pelo túbulos renais. Deste modo, o normal é não apresentar evidências de glicose na urina. Os doentes com diabetes mellitus costumam apresentar glicose na urina. Só há glicose na urina se houver excesso desta no sangue ou se houver doença nos rins.
-Proteínas: normalmente sua presença é mínima, mas se apresentarem em alta quantidade é sinal de doença renal, e deve ser previamente investigada.
-Hemácias, hemoglobina ou sangue na urina: a presença na urina pode ocorrer por diversos motivos, desde um falso positivo devido à menstruação, até infecções, doenças renais graves e doenças do trato urinário.
-Leucócitos: A presença de leucócitos na urina costuma indicar que há atividade inflamatória nas vias urinárias. Em geral sugere infecção urinária, mas pode estar presente em várias outras situações, como traumas, drogas irritativas ou qualquer outra inflamação não causada por um agente infeccioso.
-Cetonas: são produtos da metabolização das gorduras. Não estão presentes na urina. A sua detecção pode indicar diabetes descompensado ou jejum prolongado.
-Urubilinogênio ou bilirrubina: podem indicar doença hepática (fígado) ou hemólise (destruição anormal das hemácias). A bilirrubina só costuma aparecer na urina quando os seus níveis sanguíneos ultrapassam 1,5 mg/dL.
-Nitritos: A urina é rica em nitratos. A presença de bactérias na urina transforma esses nitratos em nitritos. Logo, fita com nitrito positivos é um sinal da presença de bactérias. Nem todas as bactérias têm a capacidade de metabolizar o nitrato, por isso, nitrito negativo de forma alguma descarta infecção urinária.
2º uma parte da urina que é colocada em um tubo é levada para centrifugação, para que possam realizar a análise microscópica dos sedimentos e verificar a presença de leucócitos e cilindros, células epiteliais, cristais e outros corpos presentes na urina.
REFERÊNCIAS BIBLIOGRÁFICAS
LIVROS:
• HENRY, John Bernad. Diagnósticos Clínicos e tratamento por métodos laboratoriais. 20ª Edição. Editora: Manole. Barueri-SP, 2008.
• SILBERNAGL, Stefan; DESPOPOULOS, Agamemnon. Fisiologia texto e atlas. 7ª Edição. Editora: Artmed. Porto Alegre, 2009.
INTERNET:
• INSTITUTO DE PATOLOGIA CLÍNICA H. PARDINI. Manual de Exames. 2002. Disponível em: www.hermespardini.com.br;
segunda-feira, 25 de julho de 2011
Bactéria “gigante”: algumas espécies são visíveis a olho nu

Se você achava que bactéria era sinônimo de “ameaça invisível”, lamento informar que você não está de todo certo.
De fato, a maioria das bactérias é minúscula, muito pequena para ser vista a olho nu. Há boas razões para isso: enquanto as células complexas das plantas e animais têm sistemas de transporte internos para mover moléculas ao redor, as bactérias se baseiam principalmente na difusão para mover coisas ao redor de suas células. Uma vez que a difusão só funciona bem em distâncias de até alguns milionésimos de metro, as bactérias não podem crescer muito.
No entanto, algumas espécies conseguiram realizar a façanha. Na verdade, pelo menos três são tão grandes que podem ser vistas sem ajuda de um microscópio.
A primeira gigante foi descoberta em 1985, mas devido ao seu tamanho, não foi reconhecida como uma bactéria até oito anos mais tarde. A Epulopiscium fishelsoni (na foto) tem a forma de bastonete, vive no intestino de peixes-cirurgiões no Mar Vermelho, e chega até 0,7 milímetros de comprimento (o que é centenas de vezes maior do que, por exemplo, a bactéria E. coli que mora no nosso intestino e tem cerca de 0,002 milímetros de comprimento).
A E. fishelsoni alcança esse tamanho “máximo” por ter dezenas a centenas de milhares de cópias de seu DNA.
Isso significa que ela pode produzir proteínas em muitos lugares diferentes em sua célula, de forma que elas só precisam se difundir a uma curta distância para chegar até onde são necessárias. Cálculos recentes mostram a proporção de DNA por volume na E. fishelsoni é o mesmo para uma bactéria de tamanho normal.
A E. fishelsoni manteve o título de maior bactéria até 1997, quando Thiomargarita namibiensis apareceu para concorrer na categoria.
A T. namibiensis, que significa “pérola de enxofre da Namíbia”, por causa dos grânulos de enxofre brilhantes que moram dentro dela, chega a até 0,75 milímetros de diâmetro.
A bactéria conta com o mesmo truque de E. fishelsoni: milhares de cópias de seu DNA. Embora tenha um volume até 100 vezes maior do que a E. fishelsoni, a maior parte deste espaço é usado para armazenamento: 98% da célula é ocupada por uma membrana enorme, ou vacúolo.
Este vacúolo contém até três meses de fornecimento de nitrato, que a bactéria usa para oxidar o sulfeto de hidrogênio do qual se alimenta. O armazenamento é necessário porque o fornecimento de nitrato no fundo do mar é irregular, dependendo de animais mortos que afundam.
Uma bactéria quase idêntica a T. namibiensis, com 0,5 milímetros de diâmetro, também visível a olho nu, foi descoberta no México em 2002. Isso prova que provavelmente há mais bactérias gigantescas por aí, esperando para serem encontradas
BIBLIOGRAFIA:
www.hypescience.com
Acadêmica: Karen Quevedo
quinta-feira, 19 de maio de 2011
LISTERIA

As listérias se assemelham ao gênero Brochothrix. Ambos os gêneros são catalase-positivos e tendem a estar associados ao outro na natureza, assim como o Lactobacillus. Todos os três gêneros produzem ácido láctico a partir da glicose e de outros açúcares fermentados, mas os lactobacilos são catalase-negativos. Em certo momento as listérias foram colocadas na família Corinebacteriaceae, mas atualmente estão relacionadas à Bacillus, Lactobacillus e Streptococcus. A partir da seqüência de RNA ribossomal 16S, a Listeria está classificada próximo a Brochothrix, e estes dois gêneros, juntamente com Staphylococcus e Kurthia, ocupam uma posição entre o grupo dos Bacillus e dos Lactobacillus/Streptococcus dentro da ramificação Clostridium-Lactobacillus-Bacillus, onde a porcentagem de G+C de todos esses membros é inferior a 50%. Transferências genéticas ocorrem entre Listeria, Bacillus e Streptococcus, e reações imunológicas correm entre Listeria, Stphylococcus e Lactobacillus.
Listeria spp. contêm ácidos teicóico e lipoteicóico, assim como bacilos, estafilococos, estreptococos e lactobacilos, mas diferentemente destes grupos, suas colônias brilham quando visualizadas por luz transmitida obliquamente.
As listérias estão amplamente distribuídas na natureza e podem ser encontradas em vegetação deteriorada, solos, fezes de animais, silagem, esgotos e água. Em geral, podem ocorrer em locais onde bactérias corineformes estão presentes. Sua associação com certos produtos lácteos e silagem é bem conhecida, assim como a associação desses produtos de ácidos lácticos.
Oito espécies estão relacionadas ao gênero Listeria - L. monocytogenes, L. ivanovii, L. innocua, L. welshimeri, L. seeligeri, L. denitrificans, L.murrayi e L.grayi-, o mesmo tem sofrido constantes alterações taxonômicas. A espécie L. denitrificans foi reclassificada como Jonesia denitrificans e, recentemente as espécies L. grayi e L. murrayi foram agrupadas em uma única espécie, Listeria grayi. A espécie ivanovii, por sua vez, foi subdividida em duas subespécies: L. ivanovii subsp. ivanovii e L. ivanovii subsp. landoniensis. Mas a principal espécie patogênica e de importância para a microbiologia de alimentos é a Listeria monocytogenes.
A Listeria monocytogenes foi descrita pela primeira vez em 1911, desde então ela tem sido apresentada como um patógeno de mais de 50 mamíferos, incluindo humanos, e de aves silvestres, peixes e crustáceos. O primeiro caso de listerose humana, patologia provocada pela presença de Listeria, foi relatado em 1929, mas foi na década de 80 que se tornou um dos mais importantes patógenos veiculados por alimentos, isso devido à eclosão de diversos surtos de listerose humana.
A Listeria monocytogenes é um bacilo Gram-positivo, não formador de esporo, anaeróbio facultativo. E leva o nome de monocytogenes por apresentar atividade produtora de monócitos. Onde as células jovens, quando observadas no microscópio, apresentam-se na forma lisa, assemelhando-se a pequenos difteróides, medindo de 1,0 a 2,0μ por 0,5μ. Após três a cinco dias de incubação, no entanto, apresentam-se como bacilos longos, medindo de 6 a 20μ. O número de células presentes nos alimentos para que ocorra seu crescimento irá depender do tipo de alimento, e as taxas de prevalência podem variar de 105 a 108. Ela é móvel devido a flagelos peritríquios, apresentando movimentação característica chamada de tombamento, que auxilia na sua identificação. Apresenta catalase positiva e oxidase negativa.
Em estudos epidemiológicos, são importantes os esquemas de sorotipagem e fagotipagem. O esquema atual de sorotipagem de Listeria baseia-se na identificação de 15 antígenos somáticos (O) e cinco flagelares (H), sendo 16 sorovariedades reconhecidas para as cinco espécies do grupo um: L. monocytogenes, L. innocua, L. seeligeri, L. ivanovii subsp. ivanovii e L. ivanovii subsp. Landoniensis e L. welshimeri. O grupo dois é composto pela espécies Listeria grayi contém antígenos O e H específicos. Atualmente, existem 27 fagos para tipificação de L. monocytogenes.
Além da sorotipificação, muitos outros métodos têm sido aplicados para a caracterização de espécies e subespécies de L. monocytogenes. Entre os vários métodos, estão a tipificação por bacteriófagos, a tipificação por eletroforese com enzimas multilocus, análise por enzima de restrição, a eletroforese em gel de campo pulsado, fragmentos de restrição de tamanhos polimórficos de DNA e a tipificação ribossomal.
1.1 Crescimento
As necessidades nutricionais das listérias são típicas das bactérias Gram-positivas. Elas crescem bem em meios comuns como BHI, caldo triptona e caldo tripticase-soja. Embora muitas das necessidades nutricionais tenham sido descritas para L. monocytogenes, acredita-se que as demais espécies tenham necessidades similares. Pelo menos quatro vitaminas do complexo B são necessárias- biotina, riboflavina, tiamina e ácido tioctico-, bem como os aminoácidos cisteínas, glutamina, isoleucina e valina. A glicose aumenta o crescimento de todas as espécies, e vários outros carboidratos simples ou complexos são usados. A Listeria ssp. assemelha-se aos enterococos por ser capaz de hidrolisar esculina e crescer na presença de 10 a 40% de bile, 10% de NaCl, 0,025% de acetato de tálio e 0,04% de telurito de potássio, mas, diferentemente dos enterococos, ela não cresce na presença de 0,02% de azida de sódio. Ao contrário da maioria das bactérias Gram-positivas, as listérias crescem em ágar MacConkey. Embora o ferro seja importante para o crescimento in vivo, a L. monocytogenes aparentemente não possui composto ferro-específico, obtendo o que necessita por meio da mobilização de ferro livre reduzido, o qual se liga a receptores de superfície.
1.1.1. Efeito do pH
O pH ótimo para crescimento para o crescimento desta bactéria está entre 6 e 8, ela pode crescer em uma faixa maior, entre 5 e 9. Em meios de cultura, já se verificou seu crescimento em pH 9,5. Ambientes com pH inferior a 4,5 e superior a 9,5 são considerados hostis a L. monocytogenes. Mas existem relatos de crescimento em meio de cultura com pH de 4,4.
Em geral, o pH mínimo de crescimento de uma bactéria varia em função da temperatura de incubação, composição dos nutrientes, atividade da água e presença e quantidade de NaCl e outros sais inibidores.
1.1.2. Efeito de temperatura
L. monocytogenes apresenta crescimento na faixa de 2,5°C a 44°C, embora existam relatos sobre o crescimento a 0°C. Este microrganismo suporta repetidos congelamento e descongelamentos. O tempo de geração a 35ºC varia conforme o meio em que se encontra. Em meio de cultura de ágar tripticase-soja o crescimento de 78 linhagens de L. monocytogenes ocorre dentro de uma faixa de 0,5ºC a3,0ºC.
1.1.3 NaCl
Com relação à concentração de NaCl, contatou-se a sua sobrevivência em 10,5% incubada a 37ºC por 15 dias e 10 dias, respectivamente. Em concentrações de 20%-30% de NaCl, o tempo de sobrevivência foi reduzido para cinco dias. Mas, se a temperatura é reduzida para 4ºC, a bactéria pode sobreviver por mais de 100 dias em concentrações entre 10,5% e 30,5% de NaCl. Existe uma interação do Ph com o NaCl e a temperatura.
Em estudos foram observados crescimentos em pH de 4,66 o tempo para crescimento visível foi de cinco dias a 30ºC,sem adição de NaCl; oito dias, a 30ºC, com 4% de NaCl; e 13 dias, a 30ºC, com 6% de NaCl. Crescimento a 5º ocorreu somente após nove dias em pH 7,0 sem adição de NaCl; com adição de 4% de NaCl, em 15 dias foi observado crescimento; e com 6% de NaCl, foram necessários 28 dias. Os efeitos do pH e do NaCl foram determinados por serem puramente aditivos e, em nenhum momento, sinergéticos.
1.1.4. Efeito de Atividade da água
A atividade de água ótima para que ocorra crescimento é próxima a 0,97. Mas esta bactéria consegue se multiplicar em atividade de água considerada baixa para a multiplicação de patógenos, 0,92. Existem relatos de sobrevivência de L. monocytogenes a 4ºC por pelo menos 132 dias em caldo de tripticase de soja contendo NaCl na concentração de 25,5%, com atividade de água de 0,83 aproximadamente.
1.2. Características da doença.
É no intestino humano o ponto de entrada da L. monocytogenes no organismo, através das células epiteliais do ápice das microvilosidades. Onde se difundem, não só pelo interior desta célula como também de uma célula para outra. Na fase seguinte, são ingeridas por macrófagos, mas isso não significa uma resposta inflamatória significante. Uma vez as células de L. monocytogenes dentro dos macrófagos ficam protegidas dos leucócitos polimorfonucleares.
Estudos demonstraram que cepas virulentas são capazes de multiplicar-se em macrófagos, que são rompidos e produzem septicemia. Com isso o microrganismo pode atingir outras áreas do organismo, podendo envolver o sistema nervoso central, coração e outros locais. Em mulheres grávidas pode haver invasão do feto, aborto dependendo do estagio de gravidez, parto prematuro, nascimento de natimorto ou haver septicemia neonatal. Em recém-nascido quando infectado no momento do parto e os sintomas típicos de listerose são de uma meningite. A sintomatologia tem início de uma a quatro semanas após o nascimento, mas existem relatos de período de quatro dias.
Na fase entérica, a sintomatologia é semelhante de uma gripe, acompanhada de diarréia e febre moderada. Mas alguns casos estes sintomas são inaparentes. Pode ocorrer também estado de duração indefinida.
A ocorrência de bacteremia por L. monocytogenes em adultos não é rara. Febre é o sintoma mais comum, mas alguns pacientes queixam-se de fadiga, mal-estar, podendo haver presença de náusea, vômitos dores e diarréia. A mortalidade entre imunodeprimidos, debilitados e recém-nascidos é de 30%.
O comprometimento do SNC a manifestção dá-se através do aparecimento de meningite, encefalite e de abcessos. A meningite é a manifestação mais comum, ocorre principalmente em recém-nascidos e idosos. Seu desenvolvimento clínico é fulminante, com índice de mortalidade de, aproximadamente, 70%. Outras formas localizadas de listerose são a endocardite e osteomielite, mas são formas rara. O perído de incubação da listerose varia de um dia a algumas semanas, sendo dose infecciosa de L. monocytogenes desconhecida.
1.3. Mecanismo de Patogenecidade
A L. monocytogenes entra no organismo do hospedeiro por via oral, atinge o trato intestinal aderindo e invadindo a mucosa. Em seguida, a célula bacteriana é fagocitada por macrófagos. Após a lise da membrana fagocítica, é liberada no citoplasma da célula do hospedeiro, onde se multiplica rapidamente. Ocorre também a polimerização de filamentos de actina da célula do hospedeiro, formando longas caudas em uma das extremidades da célula bacteriana. Esses filamentos causam o deslocamento da bactéria no citoplasma, permitindo a invasão das células adjacentes, dando início a um novo ciclo de infecção.
Os fatores de virulência tentam explicar o mecanismo de patogenicidade de L. monocytogenes. Temos:
-Listeriolisina O (LLO)- é uma hemolisina produzida pela L. monocytogenes, faz parte da família da citolisinas formadas pela ativação de grupamentos sulfidrilas. Tem a função de mediar à lise dos vacúolos que contêm a células bacterianas, uma vez que as células mutantes não produtoras de listeriolisina são geralmente encontrados no interior destes vacúolos sendo, conseqüentemente, incapazes de se multiplicar intracelularmente.
-Fosfolipases: a L. monocytogenes produz outras duas hemolisinas a fosfatidilinositol-fosfolipase C (PI-PLC) e a fosfatidilcolina fosfolipase C (PC-PLC), que hidrolisam os lipídeos da membrana, causando ruptura da célula.
-p60: todas as cepas de L. monocytogenes sintetizam esta proteína, parece estar associada com a capacidade invasiva da bactéria, uma vez que está envolvida com a fagocitose de L. monocytogenes e mutantes rugosos apresentam uma diminuição na capacidade invasora.
-Interleucina: é uma proteína da membrana, provavelmente envolvida no mecanismo de invasão da célula do hospedeiro.
1.4. Epidemiologia
A L. monocytogenes pode ser encontrada disseminada na natureza. No homem é difícil realizar seu isolamento devido à colonização no trato intestinal. Mas já foi isolada uma grande variedade de animais gado bovino, galinhas, cachorros, lebres, peixes, larvas de insetos, dentre outros.
O primeiro suro de listerose ocorreu na década de 80 no Canadá, onde foram encontrados repolhos tipo coleslaw contaminados por L. monocytogenes. Nos EUA em 1983, ocorreu um surto que envolveu 49 indivíduos, com mortalidade de 29%, o alimento responsável foi o leite pasteurizado. Na Suíça, entre 1983 e 1987 ocorre um surto causado por queijo tipo mole, com 122 casos e 31 mortes.
A L. monocytogenes tem sido isolada em alimentos como leite cru e pasteurizado, queijos, carnes bovinas, suínas, de aves, peixes embutidos, carne moída de diferentes animais, produtos cárneos crus e termoprocessados, além de produtos de origem vegetal, de origem marinha e refeições preparadas. Isolamentos realizados em diversos países incluindo o Brasil.
Em relação à sua presença em leite pasteurizado, estudos estão sendo realizados para esclarecer a termotolerância desta bactéria. Existem duas teorias para elucidar esta questão. A primeira delas relaciona-se ao fenômeno da resposta do choque térmico: quando as células de L. monocytogenes são expostas a temperaturas sub-leteias, entre 44-48ºC, antes de serem submetidas à temperatura final de tratamento, elas apresentam um aumento de resistência térmica. A segunda teoria diz respeito à metodologia empregada para recuperação de microrganismos estressados por processamento térmico. O uso de técnicas anaeróbias para a recuperação destas células leva à recuperação de um número maior de células do que quando recuperadas na presença de oxigênio.
1.5. Medidas de controle
Para evitar a contaminação dos alimentos por L. monocytogenes, é necessárias medidas de controle no local de processamento do alimento. Sabendo que esta bactéria está amplamente distribuída e pode se desenvolver em ampla faixa de temperatura e de pH, além de ser uma das células vegetativas de maior resistência térmica, deve-se prevenir sua entrada na indústria de alimentos. Para tanto, deve-se fazer controle do microrganismo nos pontos de origem da matéria-prima através de medidas que minimizem as chances de contaminação.
Medidas que podem ser tomadas no local de produção:
- Limpeza e sanificação dos equipamentos;
- Construção de indústrias de maneira a impedir a entrada de animais, poeiras e insetos;
Evitar contato com o produto final com a matéria-prima, evitando, assim a contaminação cruzada; - Apresentação pela indústria de um setor de controle de qualidade que se aplique não somente aos parâmetros de processamento, mas também ao controle do ambiente, inclusive do pessoal.
BIBLIOGRAFIA
- FRANCO, Bernadette D. G. de Melo; Microbiologia dos Alimentos. Págs:46, 47 e 48. Atheneu. São Paulo, 2008.
- JAY, James M.; Microbiologia de Alimentos. 6ª Edição. Págs 517 a 537. Artmed. Porto Alegre, 2005
Acadêmica: Karen Quevedo
terça-feira, 15 de março de 2011
MÉTODOS ÓPTICOS
O microscópio de campo luminoso é mais o empregado em microbiologia de rotina, constituindo em duas séries de lentes (objetiva e ocular), que funcionam em conjunto na resolução de imagens. Estes microscópios geralmente empregam uma objetiva com o poder de aumento de 100 vezes, com uma ocular de aumento de 10 vezes, aumentando a amostra 1.00 vezes. Por conseguinte, as partículas com 0,2 μm de diâmetro são ampliadas até cerca de 0,2 mm, tornando-se nitidamente visíveis. A ampliação adicional não proporciona maior resolução doa detalhe, reduzindo a área visível (campo).
Com este microscópio, as amostras são visualizadas devido à diferença de contraste entre elas e o meio ao redor. Muitas bactérias são difíceis de visualizar devido à perda de contraste com o meio. Corantes podem ser usados para corara células ou organelas e aumentar seu contraste de modo a tornar mais fácil a visualização em microscopia de campo luminoso.
O microscópio de contraste de fase foi desenvolvido para aumentar as diferenças de contraste entre células e o meio ao redor, possibilitando ver células vivas sem corá-las; com microscópio de campo luminoso, preparações que coram e matam a célula precisam ser empregadas.
O microscópio de contraste de fase tem como vantagem o fato de que as ondas de luz passam através de objetos transparentes, tais como as células, aparecendo em diferentes fases, dependendo das propriedades dos materiais através dos quais elas passam. Este efeito é ampliado por um anel especial de lentes da objetivas do microscópio de contraste de fase, o que leva à formação de imagem escura em forma de luz de fundo.
O microscópio de campo escuro é um microscópio óptico no qual o sistema de iluminação foi modificado para atingir somente os lados da amostra, o que é obtido pelo uso de um condensador especial que bloqueia tanto os raios da luz direta quanto a luz refletida para o exterior através de um espelho posicionado ao lado do condensador em ângulo oblíquo, criando um “campo escuro” que contrasta contra a borda sombreada das amostras, surgindo quando os raios oblíquos são refletidos a partir das bordas da amostra em direção ascendente à objetiva do microscópio. A resolução obtida por um microscópio de campo escuro é bastante elevada. Assim, essa técnica foi particularmente valiosa na observação de certos organismos, como o Treponema pallidum, um espiroqueta com menos de 0,2 μm de diâmetro e que não pode ser observado em microscópio óptico convencional ou de contraste de fase.
O Microscópio de fluorescência é utilizado para visualizar amostras que fluorescem, que é a habilidade de absorver a luz em comprimentos de ondas curtos (ultravioleta) e não brilhar em comprimentos de onda mais longos (luz visível). Alguns organismos fluorescem naturalmente devido à presença de substancias fluorescentes, chamadas de fluorocromos. O microscópio de fluorescência é amplamente utilizado em diagnósticos de microbiologia clínica. Por exemplo, o fluorocromo auramina O, que dá um brilho amarelo quando exposto à luz ultravioleta.
O principal uso da microscopia de fluorescência é na técnica de diagnóstico chamada de imunofluorescência. Nessa técnica, anticorpos específicos (por exemplo: anticorpos contra a Legionella pneumophila) são marcados quimicamente com fluorocromo, como o isotiocianato de fluoresceína. Em seguida, tais anticorpos fluorescentes são adicionados a uma lâmina de microscópio que contém a amostra clínica. Se amostra contém algum L. pneumophila, o anticorpo fluorescente se liga aos antígenos de superfície da bactéria, produzindo fluorescência quando exposto à luz ultravioleta.
Os microscópios de interferência diferencial de contraste utilizam um polarizador para produzir luz polarizada. Os feixes de luz polarizada passam através de um prisma que vai gerar dois tipos distintos de feixes simples. Devido às ligeiras diferenças do índice de refração das substâncias para cada feixe que passa por elas, os feixes combinados não ficam totalmente na mesma fase; em vez disso, criam um efeito de interferência que intensifica as sutis diferenças na estrutura celular. Estruturas, como esporos, vacúolos e grânulos, aparecem em forma tridimensional. A microscopia da DIC é particularmente útil para a observação das células não coradas devido à sua habilidade de gerar imagens que revelam estruturas celulares internas, menos aparentes pelas técnicas de microscopia óptica.
O alto poder de resolução do microscópio eletrônico permitiu aos cientistas a visualização e o detalhamento de estruturas das células procarióticas e eucarióticas. A resolução superior do microscópio eletrônico deve-se ao fato de elétrons terem um comprimento de onda muito mais curto que os fótons de luz branca.
Existem dois tipos de microscópio eletrônico em uso feral: microscópio eletrônico de transmissão (MET) que tem muitas características em comum com o microscópio óptico, e o microscópio eletrônico de varredura (MEV), o primeiro a ser desenvolvido, e que empregada um feixe de elétrons emitido de um canhão e direcionado ou focalizado por um condensador eletromagnético sobre uma amostra delgada. À medida que os elétrons incidem na amostra, são dispersos diferencialmente de acordo com o número e a massa de átomos na amostra; alguns elétrons atravessam a amostra, sendo reunidos e focalizados por uma lente objetiva eletromagnética que fornece uma imagem da amostra a sistema de lentes protetoras para maior ampliação. A imagem é visualizada ao incidir em uma tela que fluoresce com a incidência dos elétrons; pode ser registrada em filme fotográfico. O MET tem uma capacidade de resolução de 0,001 μm para partículas distantes. Os vírus, com diâmetro de 0,01 a 0,2 μm, podem sem facilmente observados.
Em geral, o MEV tem menor poder de resolução do que o MER, mas particularmente útil ao fornecer imagens tridimensionais da superfície dos materiais microscópicos. Os elétrons são focados através de lentes em um ponto muito fino. A interação dos elétrons com a amostra resulta na liberação de diferentes formas de radiação da superfície do material, que podem ser capturadas por um detector apropriado, ampliadas e, a seguir, apresentadas na forma de imagem em microscopia na tela de uma televisão.
O microscópio de varredura confocal a laser (MVCL) acopla uma fonte de raio laser à luz do microscópio. Na microscopia de varredura confocal a laser, um feixe de laser é espalhado contra um espelho que o direciona através de um orifício que ajusta precisamente o plano de foco do feixe a uma camada vertical no interior da amostra. Pela iluminação precisa de um único plano da amostra, a intensidade de iluminação cai rapidamente acima e abaixo do plano de foco, e a luz se perde para outros planos de focos, minimizados. Assim, em uma amostra relativamente espessa, varias camadas podem ser observadas ajustando o plano de foco da luz a laser.
Certas células são frequentemente coradas com corantes fluorescentes para torná-las mais visíveis. Alternativamente, imagens com falsas cores podem ser geradas pelo ajuste do microscópio de modo a fazer com que diferentes camadas apresentam diferentes colorações. Os MVCL são equipados com um programa de computador para juntar imagens digitais e processá-las posteriormente. Assim, as imagens obtidas da diferentes camadas podem ser armazenadas e superpostas digitalmente para reconstruir uma imagem tridimensional da amostra inteira.
BROOKS, Geo F. [et.al]; Microbiologia médica. 24ª Edição. Págs 8,9 e 10. Editora Mc Graw Hill. Rio de Janeiro,2009.

